Professor Marcus
O carbono é um elemento químico de número atômico (Z) igual a 6, o que significa que os átomos que o formam possuem seis prótons em seu núcleo. Sua massa molar é de 12,011 g/mol e na natureza são encontrados três isótopos do carbono, que são: o carbono-12, carbono-13 e carbono-14. O C-12 possui seis prótons e seis nêutrons no núcleo e é o mais abundante.
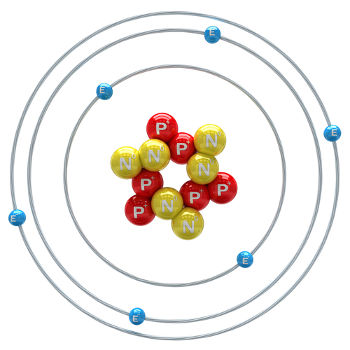
Ilustração de átomo de carbono-12
O C-13 possui sete nêutrons e é o menos abundante (1,01 a 1,14%). O C-14 possui oito nêutrons e é um elemento radioativo que emite partículas β (elétrons), sendo formado na estratosfera terrestre quando nêutrons de raios cósmicos bombardeiam o Nitrogênio-14 presente nessas camadas superiores da atmosfera. Ele é incorporado por todos os vegetais e animais e, sabendo-se que seu período de meia-vida é de cerca de 5730 anos, é usado para determinar a idade de fósseis entre 100 e 40 mil anos. Mais detalhes sobre o C-14 e a técnica de datação podem ser vistos no texto O que é Carbono-14?
O carbono é tetravalente, ou seja, precisa de mais quatro prótons na sua camada de valência (camada mais externa) para obedecer à regra do octeto. Por isso, ele geralmente faz quatro ligações covalentes, compartilhando quatro pares de elétrons com outros elementos e também com outros carbonos. Essas ligações podem ser simples, duplas ou triplas e resultam na formação de milhões de compostos diferentes. Por essa razão, criou-se uma área da Química, a Química Orgânica, que estuda os principais compostos derivados do carbono, com exceção de alguns casos que são de origem mineral, como o dióxido de carbono (CO2), o monóxido de carbono (CO), o carbonato de cálcio (CaCO3), o hidrogenocarbonato de sódio ou bicarbonaro de sódio (NaHCO3), entre outros. Esses compostos são estudados na Química Inorgânica.
O carbono realiza alotropia, formando substâncias simples, isto é, substâncias que são formadas somente por ligações entre átomos de carbono. Existem pelo menos sete alótropos do carbono, que são grafite (alfa e beta), diamante, lonsdaleíta (diamante hexagonal), caoíta, carbono (VI) e os fulerenos. Há, na verdade, vários tipos de fulerenos, que são formas alotrópicas sintéticas do carbono. Eles possuem estrutura poliédrica com um átomo de carbono em cada vértice e um exemplo é o C60 denominado de buckminsterfullerene, sendo que sua estrutura parece com uma bola de futebol.
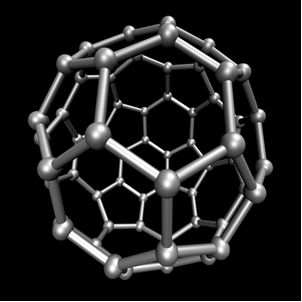
Carbono-60 (buckminsterfullerene)
No entanto, entre esses alótropos do carbono, existem somente dois que são naturais, trata-se da grafite e do diamante. Eles diferenciam-se somente pelo arranjo cristalino dos átomos no espaço, conforme mostra a figura a seguir, e isso resulta em propriedades físico-químicas totalmente diferentes. Leia o texto Alotropia do carbono para mais informações.

As duas formas alotrópicas naturais do carbono são grafite e diamante
Outra forma alotrópica sintética do carbono são os nanotubos (imagem a seguir) que apresentam amplas aplicações biológicas, incluindo diagnósticos e tratamentos médicos.

Ilustração de um nanotubo de carbono microscópico
Assim, o carbono está presente em tudo ao nosso redor e dentro de nós, pois ele compõe compostos orgânicos naturais — como os combustíveis fósseis, que incluem o petróleo, o carvão e o gás natural, e outros combustíveis, como o etanol e os biocombustíveis —, produtos agrícolas, entre outros. Forma também compostos orgânicos sintéticos, como fibras sintéticas que formam os tecidos, os medicamentos, os polímeros que formam os plásticos e as borrachas, inseticidas, corantes e muito mais. Dentro de nós, dos animais e dos vegetais, o carbono forma compostos importantíssimos, a exemplo dos carboidratos, como o açúcar, a glicose e a celulose; as proteínas que formam, por exemplo, o DNA, e que junto aos lipídios formam as membranas dos glóbulos vermelhos e dos glóbulos brancos.
Tudo isso mostra a importância do carbono para a manutenção da vida. Mas ele tem sido associado também a aspectos negativos, como a intensificação do efeito estufa e o consequente aquecimento global, isso porque o principal vilão desses problemas é o seu composto gás carbônico (CO2). Principalmente em face da grande queima de combustíveis fósseis que liberam esse gás, a concentração de CO2 na atmosfera tem aumentado. Por ser um gás estufa, ele causa os problemas mencionados. Por outro lado, o dióxido de carbono também está presente em reações vitais, como a fotossíntese e a respiração.
Por Jennifer Fogaça
Graduada em Química
Exercicio(para responder no caderno)
1. o que é carbono?
2. Quais são os isótopos de carbono encontrados naturalmente na natureza?
3. Quais são as duas formas alotrópicas do carbono?
4. Explique com suas palavras a importância do carbono!!

Nenhum comentário:
Postar um comentário